下拉刷新
加载中...
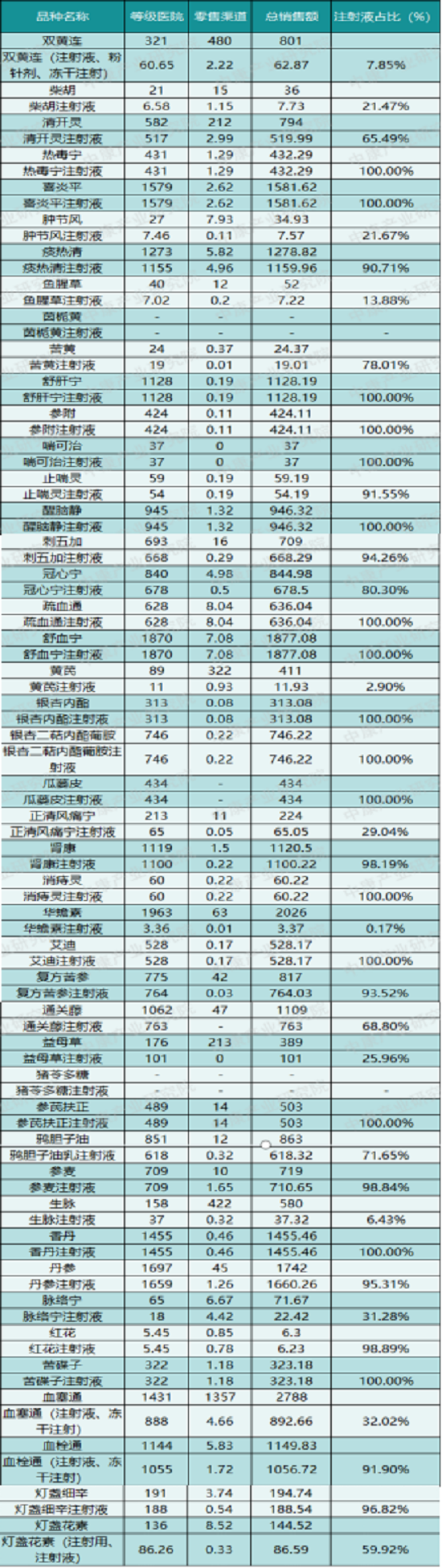
“松绑”中药注射剂,还有哪些路要走?(附医保内品种销售表)
2023-12-22 09:53:20
推荐资讯
-
产业观察 2023中医药文化国际传播交流会在京举行2023-12-21 16:56
-
产业观察 食药物质目录大全(2023年11月最新版)2023-12-20 10:55
-
产业观察 中国中药协会团体标准发布公告《适用于基层医疗机构电子交易的中药饮片商品规格等级》第二批2023-12-20 10:09
-
产业观察 新增32个品种!2023年「三无一全」品牌品种发布仪式在深圳举行2023-12-20 09:56
-
产业观察
9035种,四川中药资源品种据全国第一
2023-12-19 16:49
热门资讯
-
产业观察
那些产业发展的人和事---连翘记忆(二)《农民专家张双军研究新品种、助力连翘高质量发展》
2026-01-14 11:11
-
产业观察
投稿资讯|内外协同 政策护航:2026年中药材产业稳健转折与发展展望
2026-01-12 13:32
-
产业观察
施甸太平镇:中草药“飘香”群众致富路
2026-01-14 14:19
-
产业观察 民乐:做大做强中药材产业 为强业富民注入活力2026-01-29 11:27

-
产业观察
“8+10” 民生实事系列丨 “中药处方一件事”
2026-01-16 11:22
-
产业观察 云南鲁甸:独蒜兰喜获丰收2026-01-15 16:12
上拉刷新
加载中...
正在加载