下拉刷新
加载中...
一致性评价已成国采格局最重要变量!204 个品种通过,齐鲁最多!
2020-01-19 16:43:00
推荐资讯
-
产业观察
盘点:2020版药典那些被改动过的中药材
2020-01-17 15:53
-
产业观察
2019年12月中国中药材及中式成药出口量为1.5万吨 同比增长25%
2020-01-15 14:16
-
产业观察
中药临床证据有了量化评价指标
2020-01-15 11:25
-
产业观察
9种中药纳入食药试点管理
2020-01-15 10:52
-
产业观察
注意!四川这19个中药饮片炮制规范被叫停
2020-01-15 09:52
热门资讯
-
产业观察
专题文章 | 黄河流域中药资源现状与产业高质量发展建议
2026-02-12 13:30
-
产业观察 2025年中药类商品进出口分析2026-02-12 11:21

-
产业观察
以“质”为犁 深耕中药材种植希望的田野
2026-02-12 11:49
-
产业观察
新春走基层|中医药文化添彩年货集市
2026-02-12 10:56
-
产业观察 富兴镇:丹参红了,中药材种出“甜日子”2026-02-12 10:21

-
产业观察 土里掘“金”,小药材种出大希望2026-02-12 10:31

上拉刷新
加载中...
正在加载
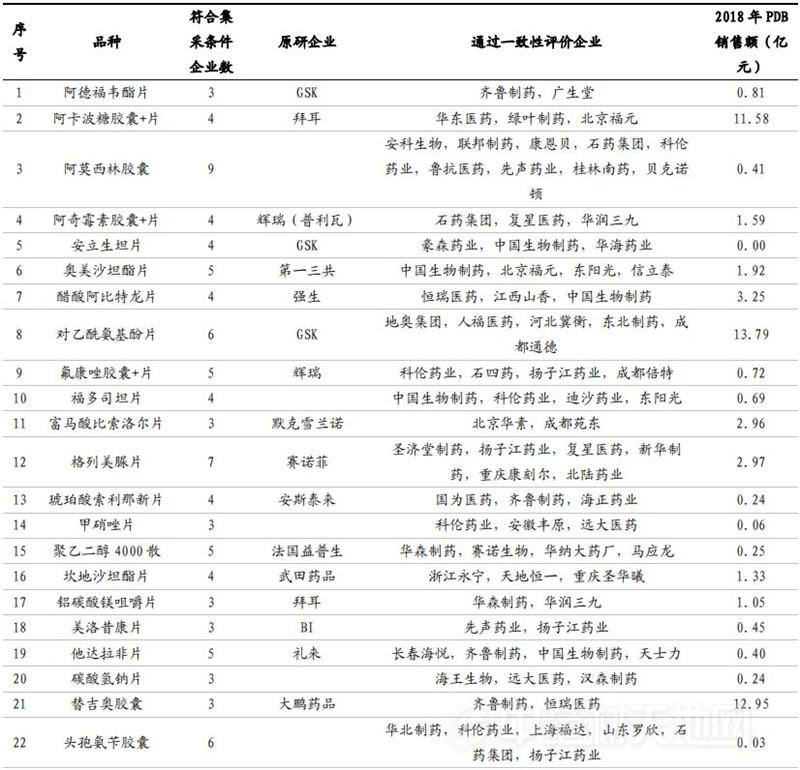
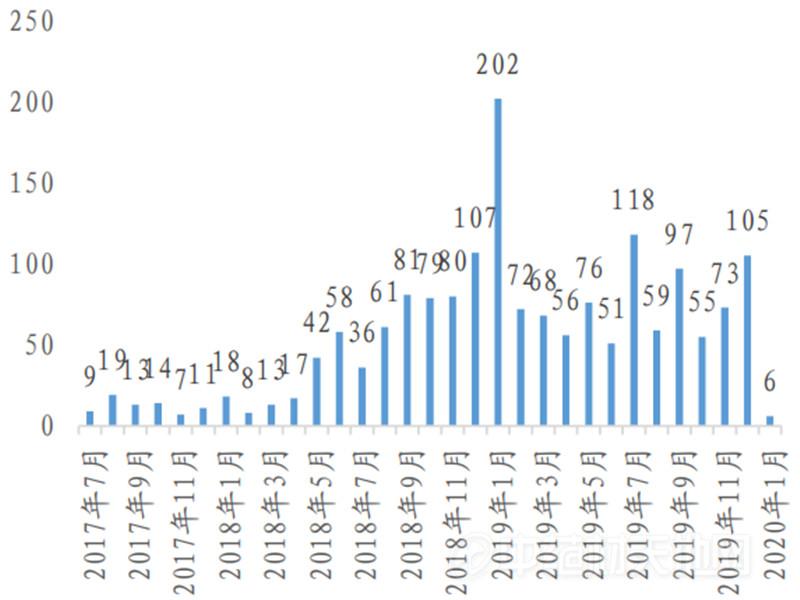
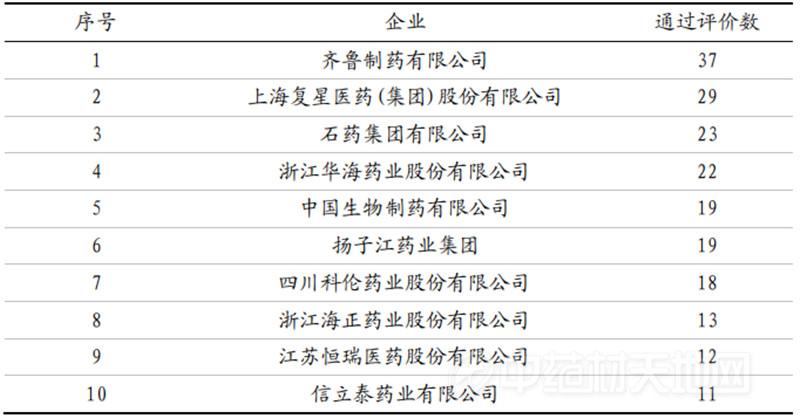

 数据来源:CDE、国泰君安证券研究
数据来源:CDE、国泰君安证券研究
 数据来源:CDE,国泰君安证券研究
数据来源:CDE,国泰君安证券研究 数据来源:CDE,国泰君安证券研究
数据来源:CDE,国泰君安证券研究 数据来源:CDE,国泰君安证券研究
数据来源:CDE,国泰君安证券研究