下拉刷新
加载中...
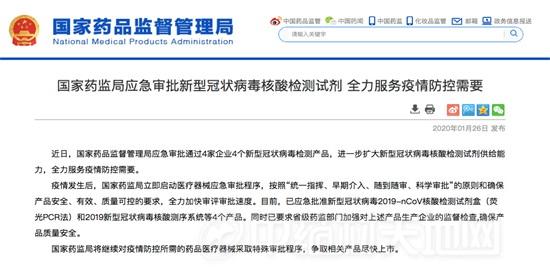
华大产品通过国家应急审批:将紧急追加生产20万人份试剂盒
2020-01-29 19:51:03
推荐资讯
-
产业观察 各方联合合力防控疫情 疫情无情人间有爱2020-01-29 15:34

-
产业观察
中国财政部紧急预拨疫情防控补助资金44亿元
2020-01-29 09:38
-
产业观察 病例还会不会大规模增加?听钟南山怎么说2020-01-28 20:00

-
产业观察 一场没有硝烟的战争:面对疫情 我们从容直面2020-01-28 15:36

-
产业观察 新型冠状病毒感染的肺炎诊疗方案(试行第四版)2020-01-28 11:56

热门资讯
-
产业观察
专题文章 | 黄河流域中药资源现状与产业高质量发展建议
2026-02-12 13:30
-
产业观察 2025年中药类商品进出口分析2026-02-12 11:21

-
产业观察
以“质”为犁 深耕中药材种植希望的田野
2026-02-12 11:49
-
产业观察
新春走基层|中医药文化添彩年货集市
2026-02-12 10:56
-
产业观察 富兴镇:丹参红了,中药材种出“甜日子”2026-02-12 10:21

-
产业观察 土里掘“金”,小药材种出大希望2026-02-12 10:31

上拉刷新
加载中...
正在加载