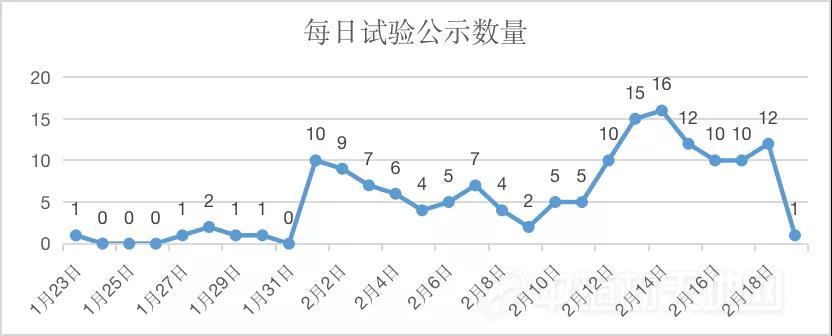
据E药经理人不完全统计,从2020年1月23日开始至2020年2月18日,短短26天时间内,已经有156项与新型冠状病毒肺炎相关的临床试验在中国临床试验注册中心官方网站上进行披露。其中,除16项临床试验尚需等待通过伦理委员会审批或补充其他材料外,其余的均已处于正常申报状态。
从研究类型来看,这些实验又可以分为干预性研究(108项,占比69.2%)、观察性研究(35项,占比22.4%)、诊断试验(8项,占比5.1%)、预防性研究(2项,占比1.2%)、预后研究(1项,占比0.6%)。其中,干预性研究显然是最为重头的研究,这部分试验往往聚焦于各类药物的疗效性与安全性评价,所涉及的患者也覆盖了从轻症/重症新冠肺炎患者各种类型。
E药经理人对这108项干预性研究进行了重点观察,并根据一些条件进行了筛选,包括排除了一些关于患者出院后康复或心理健康恢复的研究等,重点关注当前在进行的干预性研究中相关药物的临床试验情况,得出以下几个结论:
制表:E药经理人 数据来源:中国临床试验注册中心
1、中医、中药相关的临床试验占比最多,为42.8%,化药和生物药的占比则类似,分别为30.5%和23.4%。
2、老药新用是当前临床试验的主流思路,不管是中药还是化药,基本上都是在已有产品的基础来进行进一步的临床,以验证对新冠肺炎的疗效及安全性。
3、步入2月份是临床试验登记公示的高峰。在此之前,相关临床试验尚未每天更新,且每天仅有1-2例公示,2月1日起数量骤增,到2月14日为日公示临床试验数量最多的一天,为16例。
4、在统计之列的98个临床试验登记,共拟纳入受试者超过15000人,其中最多的是一项拟入组人数1000人的中医防治新型冠状病毒肺炎的单臂研究,而其次则是一项由浙江大学医学院附属第一医院发起的评价重组细胞因子基因衍生蛋白注射液联合阿比多尔、洛匹那韦/利托那韦在新冠病毒感染患者中的有效性和安全性的试验,拟入组人数达600人。
临床试验药物:共覆盖六大类
从当前已经披露的信息来看,大量的临床试验已经涵盖了已上市药物新适应证拓展、相关中成药研究、细胞疗法、疫苗以及未上市药品的相关研究。比如西药方面,有已经上市的抗疟老药氯喹,也有流感药物阿比多尔,还有抗艾药物利托那韦等研究。传统中医方面,有双黄连口服液、痰热清注射液、热毒宁注射液、金银花汤剂,也有太极拳辅助康复。细胞疗法方面,有脐血干细胞、宫血干细胞和脐血NK细胞治疗。而备受关注的单抗也出现在了临床之列。
金斯瑞生物药发现部总监殷刘松博士在接受E药经理人采访时指出,新型冠状病毒引起的疾病本质上是免疫系统相关的疾病,而免疫系统最核心的作用是维持机体的平衡,一方面是对外,外部有病原体侵染患者,可以依靠激活免疫力来对抗外部的病原体,另一方面是维持自身免疫力的平衡,将平衡保持在可控的范围之内,避免产生更大炎症。
而从药物作机理上看,现有临床试验的药物总共可以被分为6类,分别作用于病毒和作用于机体本身。
第一种药物疗法基于免疫系统病毒特性,目前的疗法非常多,潜力最大的是针对病毒的RNA聚合酶或蛋白酶抑制剂。这一类也是当前研究最多的,一些热门的药物例如瑞德西韦(吉利德,RNA聚合酶抑制剂)、法匹拉韦(海正,RNA聚合酶抑制剂)、洛匹那韦(艾伯维,蛋白酶抑制剂)等都属于这一类,其主要通过阻断病毒复制或者病毒侵染过程来实现治疗目的。
第二大类则是疫苗。根据统计,目前国内外有30多家企业正在开发相关类型疫苗,国内已启动疫苗研究的除国家及各个地方的疾病研究中心,还包括一些上市公司如智飞生物、华兰生物、未名医药、辽宁成大、康泰生物、沃森生物、博雅生物等。国外对疫苗进行开发的企业包含Moderna、GSK、吉利德、西安杨森、赛诺菲等。值得关注的是,Moderna做为早启动疫苗的公司之一,正在开发有关开发新型冠状病毒mRNA疫苗,而赛诺菲近日也宣布用基因重组技术平台加速开发新型冠状病毒疫苗。
第三大类是抗体及血浆制品。2月12日,由中国医学科学院输血研究所发起的“采集恢复期血浆治疗重症新型冠状病毒肺炎患者的研究”在中国临床试验注册中心官网公示。殷刘松博士指出,血浆制品生产方式是直接从康复病人血浆中提取特异性抗体,提取的血浆量有一定限制性,而且不是所有康复病人都适合提取血浆,比如一些重症患者,同时大规模生产有一定难度。相比起来,体外生产大规模治疗性中和抗体是非常有可操作性的。
第四类是细胞疗法,间充质干细胞疗法就涵盖在其中,核心作用是调节患者的免疫系统来减轻炎症反应。但目前关于该疗法的临床尝试还较少,上述98项临床试验中涉及到间充质干细胞的仅有三例,分别由中国医学科学院基础医学研究所(1例)和广州瑞铂茵健康管理咨询有限公司(2例)申报。
第五类是中成药。早期的辅助药多为中成药治疗,居家隔离的患者也会被鼓励吃一些中成药来预防新冠肺炎,殷刘松博士指出,“要客观的看待中成药,不能一竿子打死,但中成药目前还不是特效药,也不是救命药,大部分是调节免疫系统作用的,具体作用还需要临床验证。”
第六类则是辅助治疗,包括细胞因子抑制剂等。重症病人辅助治疗在发达国家是维持病人生存率最核心的治疗方式,中国现阶段也在加强辅助治疗,以保证降低死亡率、提高治愈率的攻坚任务,殷刘松博士指出,因为没有特效药,此举措在现阶段有非常重要的作用,拿浙江和江苏两个大省举例,江苏发病率超过500人,浙江超过1000人,到现在一个人都没有死亡,原因在于,压力没那么大的情况下,辅助治疗做的很好。
同时对于在特效药来之前的核心任务,殷刘松认为,病人维持生命最核心的就是靠这些辅助治疗:缺氧补氧,肺不行上呼吸机,细胞因子太强压制细胞因子,免疫系统太强抑制免疫系统,免疫系统太弱上提高免疫系统的。所以仍然期待有特效药和疫苗尽快通过临床验证。
单抗治疗新冠肺炎,是否有可行性?
2月13日,中国科学技术大学附属第一医院(安徽省立医院)申报的一项关于托珠单抗在新冠肺炎汇总的有效性及安全性的多中心、随机对照临床研究被公示。托珠单抗是跨国药企罗氏的一款单抗产品,而当前国内也已经有多家本土药企如恒瑞、信达也在进行PD-1抗体针对新冠病毒的临床试验。PD-1抗体作用机理和免疫系统相关,临床试验注册显示,恒瑞的PD-1抗体临床试验目标是“探讨PD-1和胸腺肽伴随淋巴细胞减少的2019新型冠状病毒感染重症肺炎患者的疗效”。
殷刘松从药物作用机理对PD-1的临床试验进行了解释。“PD-1抗体是增强免疫系统的,但很多新冠病人另外一个反应是免疫系统太强而不是太弱,这些病人是不能用PD-1抗体的。免疫系统太强的病人会攻击自己的身体,针对淋巴细胞减少的重症肺炎患可能会有些效果,这是为什么PD-1抗体也应用到临床试验的原因,从疾病本身出发,但并不是针对所有患者。”
从这个角度来看,PD-1抗体或许只能针对一小部分病人可能有一些效果,对特定临床表现的可能会有一些效果。
同时,其指出在新冠病毒治疗上,PD-1抗体可能仅限于辅助疗法,大多数新冠患者免疫系统不是因为太弱,恰恰相反是因为免疫系统太强,大部分药物是抑制免疫系统,减少对自身肺及肾脏的反应。另外,此前登革热疫苗、SARS疫苗等研究中,抗病毒蛋白抗体不仅没有能够解决病毒感染,反而还加重了病情,因为抗体增强了病人免疫系统对自身的攻击,导致了更严重的肺部损伤。
商业化可能与临床资源的利用
事实上,关于短期内大量上马临床试验的做法,此前也曾引发过一系列争议,关键因素之一,在于潜在里造成的对临床资源的浪费。
针对此问题,高特佳投资执行合伙人王海蛟在接受E药经理人采访时表示,从宏观经济层面去看这个问题,政府期盼尽快解决这个问题, 让社会秩序恢复正常,现在处于封城的状态下, 社会损失是非常巨大的,延长了两周的假期,按照去年中国经济总量接近一百万亿计算,相当于损失了1/26,当中压力有多大,从数字的计算就可以看出。从这个方面来说,政府肯定希望从多方面来尝试,尽快找到最有效的解决途径。这与药品的研发试验以及政府的支持这两个成本相对比, 都是非常小的投入了。
对于商业化的可能性,王海蛟指出,历史上这种大规模新发突发疫情的药物研发商业价值都是有待考量的,不像慢性病药物或肿瘤药物。第一点,急性传染病不是经常性的,哪怕是流感的相关药品, 相比起新型冠状病毒适应症的价值都要大,药企的投入首先基于社会责任感。第二点, 投入到现在还是有限的, 肯定是在可控范围内的投入。
与此同时,从资本市场层面过去存在相关企业蹭热度的争议,王海蛟对主流企业的社会责任持肯定的态度,“可能有过度炒作的嫌疑,但做事情要看主流,不排除主流之外有支流侧流, 这些不应当影响主流的意义。主流上企业还是从社会责任感的角度出发,从病人的需求出发,有些跨界的企业在支援一线医疗设备供应改造了厂房,可能换不回成本,这时候还是政府要推动做这个事情,更多是从全社会成本来考虑的。”
伴随瑞德西韦进入临床并推进迅速的同时,也有相关企业进行仿制药的研发,以博瑞医药举例,上周企业公告披露,已经批量生产出瑞德西韦原料药,制剂批量生产也在同时进行中。“现阶段能如此快速的做出强仿的动作,说明中国生物制药技术有很大进步”,王海蛟同时指出,“做到这一步以后企业会不会继续往下推进,需要等临床试验的结果以及疫情的发展态势,但现阶段根本是回归医药人解决病人需求的本质。”
大量临床还在路上?
值得注意的是,有行业人士向E药经理人表示,尽管当前已经有很多临床快速上马,但实际上正在做药物临床准备的企业远不止公示出的数量,还有大量的临床处于在路上的状态。
目前,卫健委发布的《新型冠状病毒肺炎诊疗方案》已经更新到了第六版,而除了此前的一些治疗药物洛匹那韦/利托那韦、利巴韦林以外,新版的诊疗方案里还增加了如阿比多尔、磷酸氯喹等新的抗病毒药物。这些产品也在积极的开展各类临床试验,有些已经显示出了较好的临床疗效。科技部生物中心主任张新民在2月16日举行的新闻发布会上也指出,“研发有效的临床就医药物,努力的降低死亡率,提高治愈率,是当前应急攻关的重中之重”。
张新民在新闻发布会上公布了药物筛选的过程,科研团队利用计算机模拟筛选,体外酶活性测试等方法,以7万个药品和核心化合物进行筛选,选出5000个可能有效的药物做为候选药物,在普通的冠状病毒感染的细胞上,进行初筛后,选定了100个左右的药物在体外开展新型冠状病毒的活性试验,再多轮筛选的基础上,科研攻关组最后聚焦到少数几个药品。可以看出,现阶段为获得有效的治疗药物,在进行大量临床验证和试错。
生物研发机构及药厂如此积极的开展临床,除了监管机构,如NMPA、CDE的利好政策以外,根本原因依然来自于在没有特效药的情况下,病人需求却在急剧增加。“还是要先回归到疾病本质,回归到患者的临床需求”,金斯瑞生物药发现部总监殷刘松博士对此向E药经理人表示。
但与此同时,也有行业人士向E药经理人分析认为,对于接下来仍有大量企业开展临床的预期,也并不应该太乐观。”早期特批药物几乎都是企业在赶着上报,因为有扶持的政策,相当于破格录取,比如有些还没有过伦理,就先批了临床。但此后钟南山院士等相关专家也对药物安全性有了一定质疑,提出要谨慎做临床试验。所以此后国家大概率也会收紧政策,按照正常的审批时间走。这样一来,一些晚上临床的可能等疫情结束还没有做完临床,这样意义就不大了,所以之后上临床的药物也可能变少。“