从“质量是检验出来的”到“质量是生产出来的”,再到“质量是设计出来的”,质量保证体系的核心原则在不断的进化着,这也体现了对药品质量全生命周期的系统性控制。然而,再完美的设计,在实际生产过程中,也会出现一定的偏差,如果对偏差的管控不严,就会使得实际生产过程越来越偏离预先批准的程序,甚至走上极端...要知道,国内外太多的药害事件都是来源于偏差的有意隐瞒和无效控制!
1. GMP体系~偏差的定义
我们先看一下对于偏差的定义!所谓偏差,是一种非预期事件,可能会影响产品的安全、质量和有效性。根据ICH定义,偏差是指对批准指令或规定标准的任何偏离。任何与已批准的质量标准、检验方法、操作规程、管理文件、工艺规程、环境和生产全过程中各种相关影响因素不相符的情况都视为偏差。
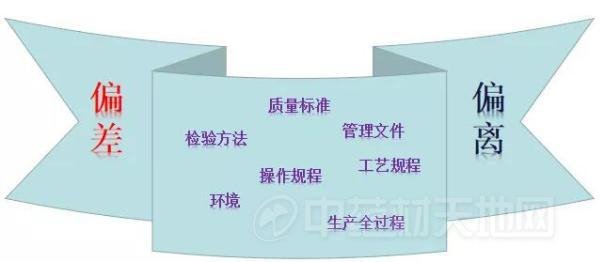
具体描述可如下:外部供应服务与规定要求不符;生产、检验、计量环节、设备设施、方法、规程设计与实际需求偏离;从事生产、检验、计量或有资质要求的岗位及人员的资质或技能与要求不符;药品生产环境检测参数与规定限度不符;生产设备、器具性能或状态与要求不符;生产、检验操作与规程不符;原辅料投料数量或药品中所含成分数量与处方不符;生产工序控制参数或动态监控参数与规定不符;物料或成品检验项目或检验数据与规定限度不符;生产过程中使用的与物料直接接触的水、气等与规定不符;生产周期超出规定要求;样品的留样观察、稳定性考察数据与规定不符;清场效果及残留检测数据与要求不符;包装材料、标签、说明书等与要求不符;批号、效期、生产日期与要求不符等。
2. GMP体系~偏差的分类
通常,企业按严重程度不同将偏差分为重大偏差和次要偏差。重大偏差是影响或可能影响产品最终质量,不符合预定用途和注册要求,导致产品返工、收回甚至销毁的事件。次要偏差是不影响产品质量或对质量影响甚微的事件。实际生产活动中偏差不可能避免,只能通过健全偏差管理体系来减少偏差的产生,对已发生的偏差进行有效控制。
除以上外,偏差的分类还有很多种形式:如按传递方式不同,可分为可传递偏差和不可传递偏差;按原因明确情况不同,可分为可见偏差和不可见偏差;按分布环节不同,可分为人员偏差、设备设施仪器偏差、物料偏差、生产工艺偏差、生产环境偏差、物料标识偏差、试验室偏差、计算机化系统偏差、质量状态管理偏差、标准/制度/规程执行偏差、记录填写偏差、追溯性偏差、变更控制偏差、人为偏差和非人为偏差等;按可控状态不同,可分为可控偏差和动态不可控偏差。
3. GMP体系~偏差的由来
常见的产生偏差的原因包括但不限于以下内容:1)生产操作与指令不符,如投料顺序的改变、操作步骤的改变、增加或减少步骤、操作失误等;2)生产工艺参数发生改变,如调节设备的温度、时间、频率;3)生产过程出现异常,如设备突然停机、设备零件损坏、因水电气导致的中断等;4)洁净区环境不符合要求,如温度、湿度、压差;5)关键工序物料平衡、产品收率不符合规定;6)检验结果不合格;7)关键岗位人员变更,如关键生产工序、关键质量把控点、检验岗位;8)其他异常情况。
4. GMP体系~偏差的处理流程
根据新版GMP第247~254条要求和偏差处理的原则,偏差处理的主要流程通常如下图所示:其中1~7步为发生偏差时及时报告、调查并处理,即纠正(纠正效果可在偏差处理过程中判定);8~13步为制定有效的纠正、预防措施,避免偏差的再次发生(有时在偏差处理时限内无法直接判定);通过整个偏差处理流程以确保产品的质量和GMP的符合。

(图片源于CNKI)
5. 国家对于GMP体系偏差的管理历程
1982年,中国医药工业公司制定了《药品生产管理规范》(试行稿),比美国晚了将近20年,药品生产偏差管理也随之相对落后,1998年版的GMP中并未涉及偏差管理的内容,直到2008年1月1日实施的《药品GMP现场检查评定标准》中才首次吸纳偏差管理概念,要求生产中出现的偏差必须得到调查和记录,但也只是提出了框架式的管理要求。2009年国家食品药品监督管理局在组织修订我国GMP的过程中,吸纳了欧盟GMP的要求,首次在规范中引入偏差管理的内容,在生产管理的各要素部门均明确提出了偏差调查、处理及记录的要求。新版GMP在2011年3月1日正式实施,对硬件、软件、人员、现场的偏差都进行了具体的规定,并在质量保证和质量控制这一章单独列出了一节,对整个质量保证系统出现的偏差的处理进行了详细的规定。
6. 国家对国内药企GMP体系偏差的调查
原国家食品药品监督管理总局发布,2017年发现企业存在研发过程中生产质量管理规范执行不足、偏差及超标调查不充分、工艺验证不科学等问题;关于偏差的主要信息如下:
1)存在对偏差结果未能及时调查,或者调查不深入、不全面,未能对产生的根本原因进行充分调查。特别是当发现稳定性试验数据偏离趋势的异常数据,未能引起足够重视,未及时开展调查,后期再查找原因变得十分困难。
2)工艺验证出现偏差不能按照药品GMP要求进行记录、分析,不能找到根本原因并制定纠正与预防措施。
3)偏差管理系统不能有效运行,一些偏差未开展偏差调查,部分偏差调查不充分。
4)质量管理体系不能有效运行,存在系统性问题。如人员资质和数量与生产要求不匹配,未对偏差、超标结果进行有效识别、调查,变更未执行变更控制程序等。
小结/小感
国内大部分药企,对偏差概念的理解和偏差调查的理念存在一定的误区,认为企业内部报告太多偏差容易招致药监部门药品GMP检查员的盘问,随之会引发一系列对企业生产销售不利的结果。一旦出现问题,整改措施通常大部分集中于“对操作人员的再培训”,甚至部分企业还经常将偏差当作“挡箭牌”,利用“计划性偏差”频繁违反相应的生产、质量管理要求。其实,如上所示,出现偏差是非常正常的现象,而如何处理偏差,并在此基础上建立相应的纠正系统,更能体现一家药企的功底和实力!毕竟,对于制药行业,要想做大做强,“质量关”虽然非常重要,但也正在逐渐成为最低要求和标准!
全文数据:1. ICH文件;2. CNKI;3. 新版GMP;4. NMPA网站
(本文转载自其他网站,不代表中药材天地网的观点和立场。如有著作权异议请及时联系我们)