下拉刷新
加载中...
点亮“证候类中药新药”研发的灯塔
2018-11-27 10:54:29
推荐资讯
-
政策解读
行业大洗牌!45万家药店分级分类:其中二、三类药店可经营中药饮片
2018-11-26 11:50
-
政策解读 一图读懂中药饮片质量集中整治:与其老生常谈,不如紧急刹车2018-11-15 14:32

-
政策解读
国务院发文:加强古代经典名方类中药制剂知识产权保护
2018-11-14 14:23
-
政策解读
国家药监局发布《证候类中药新药临床研究技术指导原则》
2018-11-07 15:57
-
政策解读
新版《基药目录》正式实施,中药地位再稳固
2018-11-01 16:56
热门资讯
-
政策解读 《福建省规范中药材产地加工(趁鲜切制)指导意见》政策解读2026-02-26 14:57
-
政策解读
学习2026年中央一号文件:关于粮经产业和农业科技创新、中药材等相关内容
2026-03-04 10:46
-
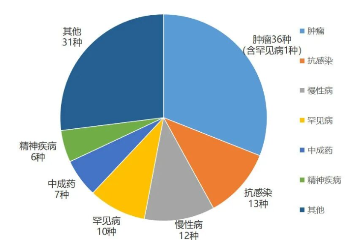
政策解读 中药产业大爆发!创新驶入快车道,医保加大支持,推进新集采……趋势解读2026-03-04 11:08
-
政策解读
2026年中药材产业的“分水岭”:要么成为“规范玩家”,要么被“集采红利”清场!!
2026-03-04 10:50
-
政策解读
《中医药继续教育管理办法(试行)》政策解读
2026-02-28 10:54
-
政策解读 学习2026年中央一号文件:关于粮经产业和农业科技创新、中药材等相关内容2026-03-04 10:44

上拉刷新
加载中...
正在加载