下拉刷新
加载中...
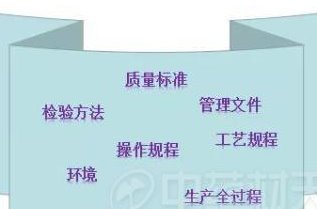
配合药品管理法修法,坚决守住药品质量底线
2019-03-25 14:20:43
推荐资讯
-
政策解读 国家药监局:修订通关藤注射液(消癌平注射液)说明书2019-03-21 16:52

-
政策解读
引入社会力量,药典委公开征集药品标准制修订承担单位
2019-03-20 16:13
-
政策解读 “开门办药典”293个标准放开,鼓励药企参与!2019-03-20 11:21

-
政策解读 《药品管理法实施条例》修订2019-03-19 15:23

-
政策解读 浅析:GMP体系下的偏差及其控制2019-03-18 15:10
热门资讯
-
政策解读
从中央政治局会议看2026年经济工作方向
2025-12-11 16:12
上拉刷新
加载中...
正在加载
