下拉刷新
加载中...
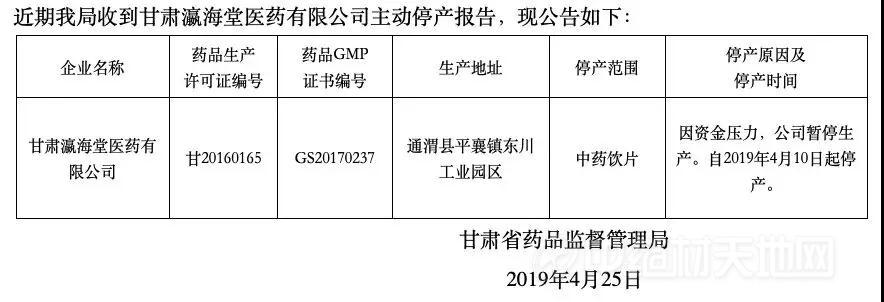
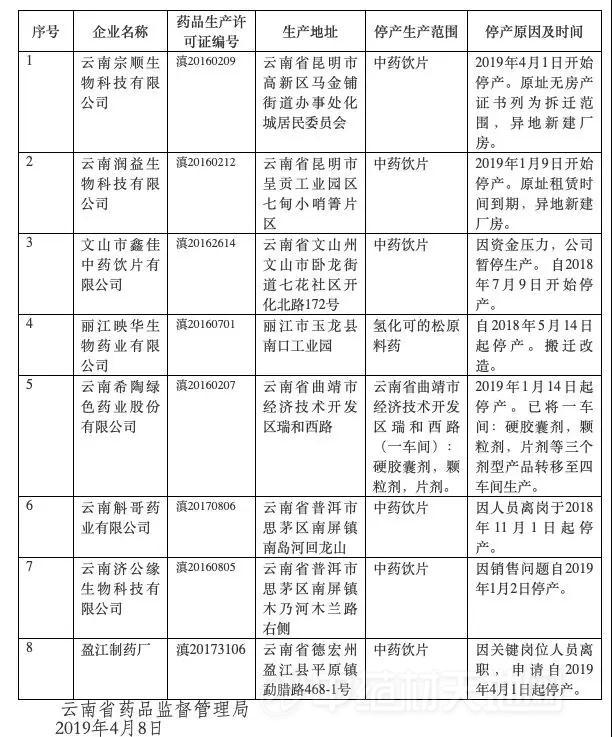
药企因资金压力大,主动向药监局报停
2019-04-28 13:29:55
推荐资讯
-
产业观察 “4+7”带量采购后药价平均降幅52%,戳穿药品集中招标采购的诸多骗局2019-04-28 11:36
-
产业观察 卫健委:未来将加快药品信息化追溯体系的建设2019-04-28 10:33

-
产业观察 2019,中药材发展的空间有哪些?2019-04-28 09:47

-
产业观察
药典委增修订内容密集发布 新版药典对中医院行业影响重大
2019-04-26 17:11
-
产业观察 中药饮片面临质量难关 江苏省药监局局长王越:关键在标准和监管2019-04-26 16:29

热门资讯
-
产业观察 运城市多部门联合开展首批中药材趁鲜切制企业资料复审2025-12-09 13:53
-
产业观察
广西:端稳国家“糖罐子” 甘肃:推动现代农业提质增效
2025-11-27 16:24
-
产业观察
推动传统名方向新药转化 江西省省完善现代化中医药产业
2025-11-27 16:23
-
产业观察
一个镇一味药,整出产值15亿——太和县李兴镇桔梗产业一线见闻
2025-12-10 11:11
-
产业观察 两部委两份年度权威数据同时公布:中医馆在暴增、药店在重构!2025-12-10 13:20
-
产业观察
兰坪:铜牛甸中草药种植增收实现“三级跳”
2025-12-10 11:08
上拉刷新
加载中...
正在加载