下拉刷新
加载中...
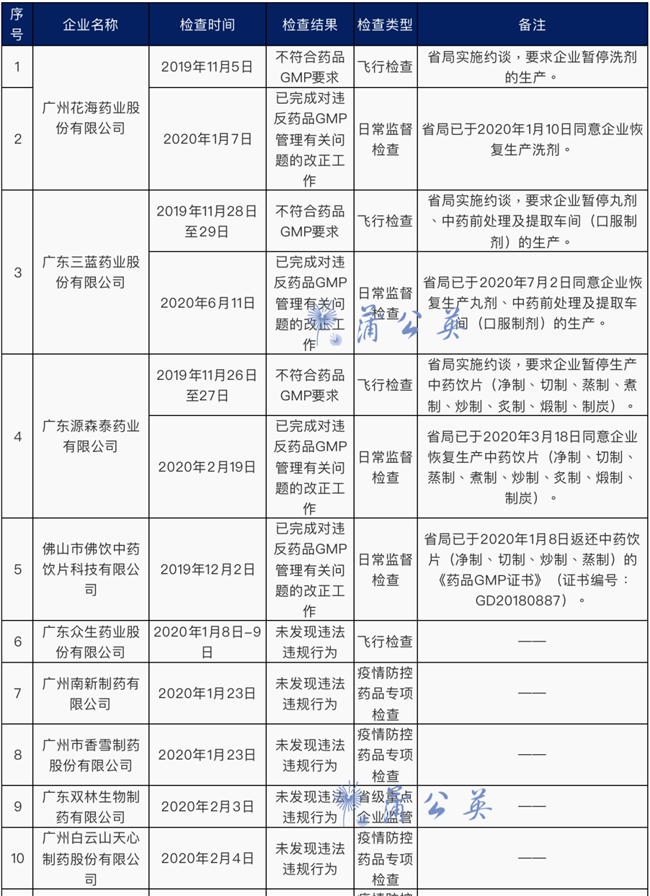
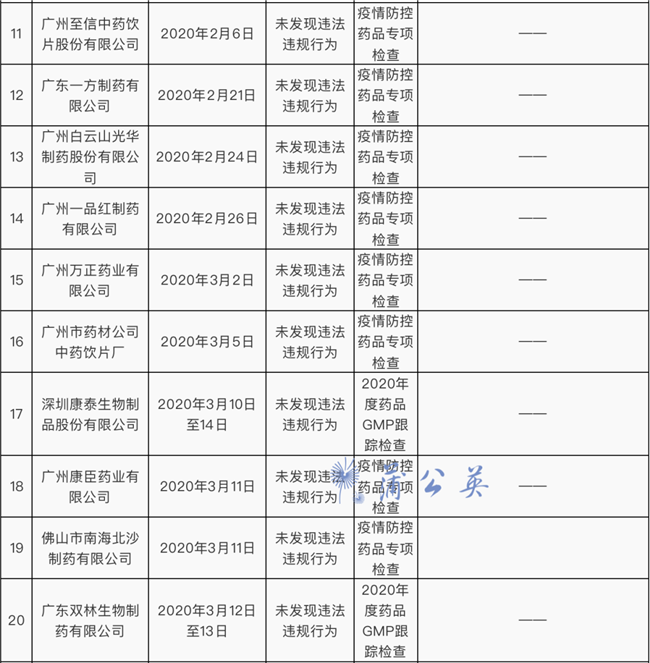
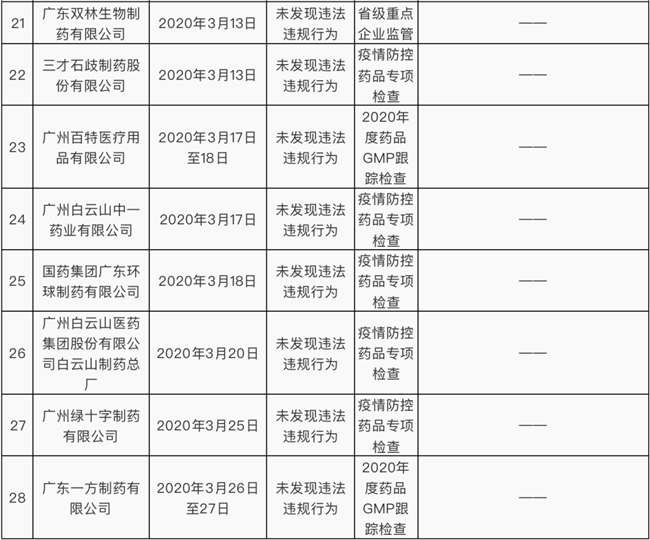
34家药企检查结果公布
2020-07-07 16:45:20
推荐资讯
-
产业观察
新政策出台 便利店卖药更方便了!
2020-07-07 16:39
-
产业观察
妇科中成药排位生变!17个独家产品抢占TOP20,2个突破5亿,三年销售数据都在这里
2020-07-07 16:21
-
产业观察 严禁捕捉野生蝎子,非法猎捕超过1000只将追究刑事责任!2020-07-07 14:07
-
产业观察
医保监管再升级!这次严查民营医疗机构这四类行为!
2020-07-06 15:56
-
产业观察
新版药典给中药企业戴上紧箍咒,检测费用或高达千万元
2020-07-06 14:16
热门资讯
-
产业观察 陇南天麻采收交易会现场签约9亿元2025-11-19 10:55
-
产业观察 运城市多部门联合开展首批中药材趁鲜切制企业资料复审2025-12-09 13:53
-
产业观察
广西:端稳国家“糖罐子” 甘肃:推动现代农业提质增效
2025-11-27 16:24
-
产业观察
推动传统名方向新药转化 江西省省完善现代化中医药产业
2025-11-27 16:23
-
产业观察
一个镇一味药,整出产值15亿——太和县李兴镇桔梗产业一线见闻
2025-12-10 11:11
-
产业观察 两部委两份年度权威数据同时公布:中医馆在暴增、药店在重构!2025-12-10 13:20
上拉刷新
加载中...
正在加载