下拉刷新
加载中...
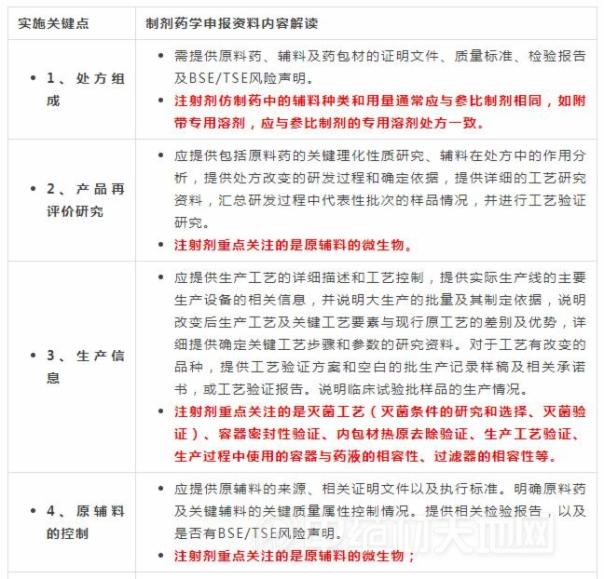
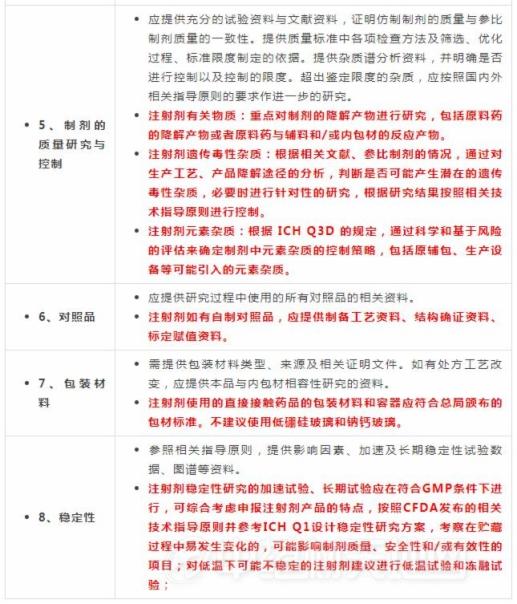
注射剂一致性评价悄然启动 医药市场加速迎来“生死劫”
2019-04-24 16:41:08
推荐资讯
-
政策解读 6月1日起实施 《河北省中药材标准》正式发布2019-04-24 10:24

-
政策解读
2019医保药品目录调整方案公布 调入调出药品猜想
2019-04-23 15:35
-
政策解读 我国医保目录动态调整专题分析2019-04-23 14:20
-
政策解读
两项中药行业国家职业技能标准发布
2019-04-19 11:33
-
政策解读 定了!国家医保局发布《2019年国家医保药品目录调整工作方案》!附全文变化标注2019-04-18 10:18

热门资讯
-
政策解读
从中央政治局会议看2026年经济工作方向
2025-12-11 16:12
上拉刷新
加载中...
正在加载