下拉刷新
加载中...
又有一省在市(州)设立省药监局检查分局,是否是大趋势?
2019-05-23 14:20:14
推荐资讯
-
政策解读
纳入集中采购 药店或不再是药企避风港
2019-05-22 14:54
-
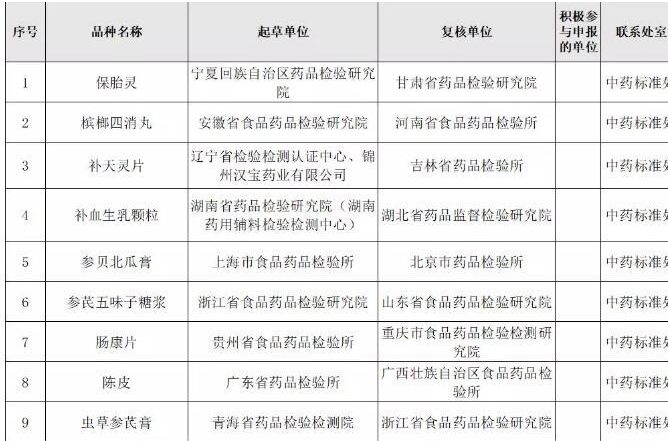
政策解读 国家药典委发布273个药品标准提高目录,包括101个中药品种2019-05-22 14:23
-
政策解读 第二轮带量采购即将开启,总理批示医保支付改革要实现突破!2019-05-21 11:29

-
政策解读 国家医保目录调入品种分析2019-05-20 15:47

-
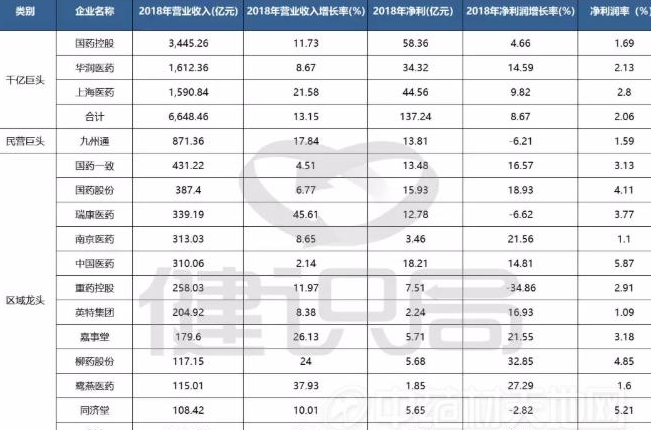
政策解读 两票制全面实施后,千亿巨头和区域药商龙头谁更“劲”?2019-05-20 15:04
热门资讯
-
政策解读
从中央政治局会议看2026年经济工作方向
2025-12-11 16:12
上拉刷新
加载中...
正在加载
