下拉刷新
加载中...
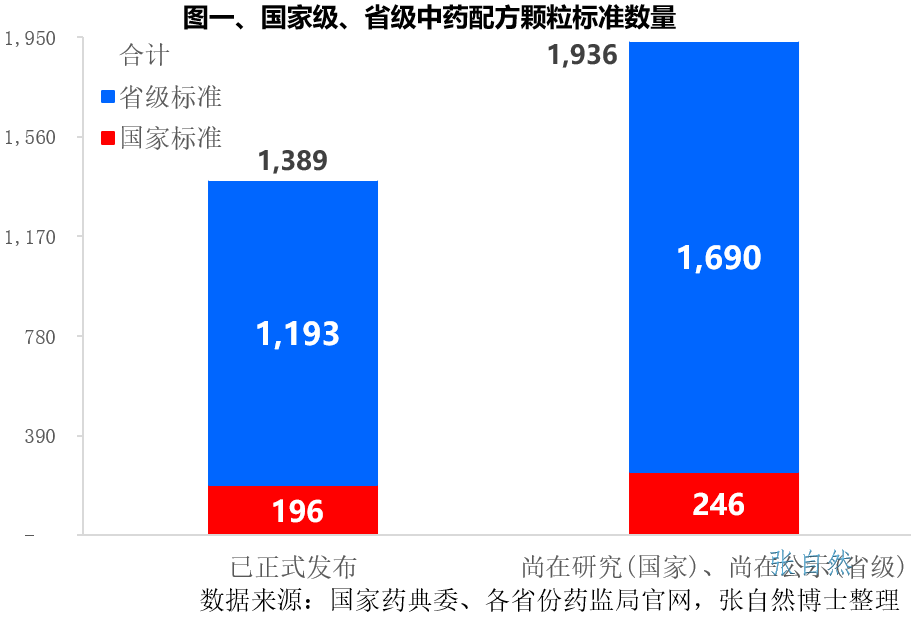
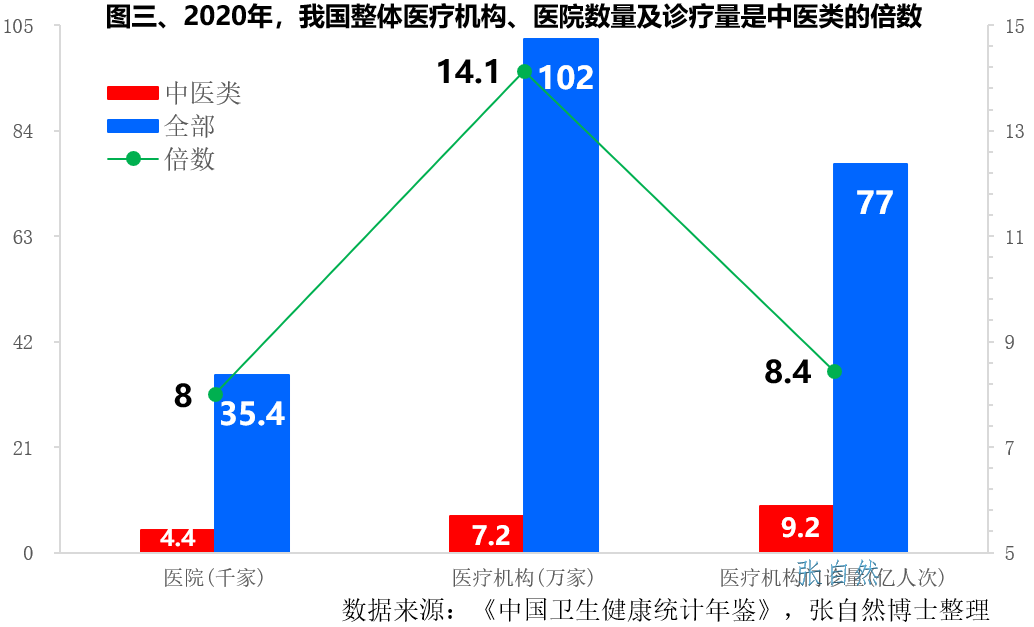
中药配方颗粒全面放开(上)
2021-11-01 16:40:21
推荐资讯
-
政策解读
为推动医药产业高质量发展,多地已发布文件规划
2021-10-25 15:01
-
政策解读 新闻发布会丨《甘肃省大宗地产中药材产地加工(趁鲜切制)工作方案》政策解读2021-10-20 10:55

-
政策解读
重磅文件发布,中药配方颗粒市场将迎大利好
2021-10-14 10:12
-
政策解读
9月医药大事件之政策篇:行业整顿风暴再升级
2021-10-08 16:27
-
政策解读
全面贯彻实施中医药法 推进中医药事业发展和健康中国建设
2021-09-24 15:27
热门资讯
-
政策解读
从中央政治局会议看2026年经济工作方向
2025-12-11 16:12
上拉刷新
加载中...
正在加载