下拉刷新
加载中...
一场注射剂再评价引发的问询与乌龙:万亿市场何处走?
2019-07-01 10:51:07
推荐资讯
-
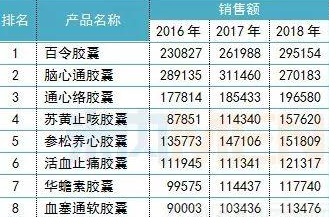
产业观察 中药注射剂不行了,中成药胶囊却卖火了2019-07-01 10:42
-
产业观察 国家中医药局发文 这些医疗机构迎来大发展2019-07-01 10:26

-
产业观察 医保局最新发文!药企注意,9月30日前须完成这项工作...2019-06-28 15:30

-
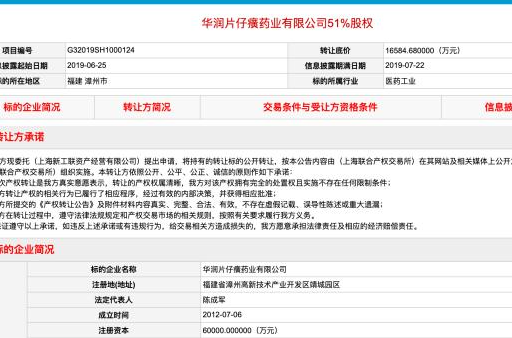
产业观察 1.66亿抛售股权,华润医药与片仔癀终敌不过“七年之痒”2019-06-28 13:43
-
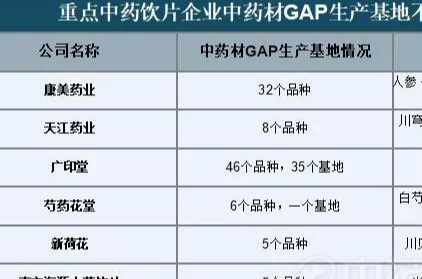
产业观察 深度丨中药饮片的中场战事2019-06-28 10:59
热门资讯
-
产业观察
专题文章 | 黄河流域中药资源现状与产业高质量发展建议
2026-02-12 13:30
-
产业观察 2025年中药类商品进出口分析2026-02-12 11:21

-
产业观察
以“质”为犁 深耕中药材种植希望的田野
2026-02-12 11:49
-
产业观察
新春走基层|中医药文化添彩年货集市
2026-02-12 10:56
-
产业观察 富兴镇:丹参红了,中药材种出“甜日子”2026-02-12 10:21

-
产业观察 土里掘“金”,小药材种出大希望2026-02-12 10:31

上拉刷新
加载中...
正在加载
