尽管有国家大力支持中医药发展的战略规划,有基本法《中医药法》出台,有享受“超药品”待遇的中药配方颗粒,有政府引导的标准化项目。但是,中药注射剂的安全性事件曾出不穷,重点监控合理用药名单和辅助用药目录虎视眈眈,新药上市通过率几近于零,中药制剂无一通过FDA审批,再加上龙头企业黑天鹅的三连击,目前中药企业处境可谓是四顾茫然。
一、中药产业概况
在一系列监管、控制措施下,中药产业疲态明显,行业洗牌已不可逆。大型中药企业纷纷转型,用多年来中药发展挣得的身家,布局化药和生物药产业。丽珠和步长已向生物医药战略转型,以岭采用中美双报的方式获批多个化药的ANDA,修正在北京和上海分别打造了化药和生物药研发平台,石家庄某大型药业几乎解散了全部的中药研发部门,集中力量发展创新药。
中药企业与时俱进是值得表扬的,但避而不谈并没有解决难题实质——中药该怎么发展?这是个中药行内人都难以回答的问题。本着迈小步也是进步的态度,笔者抛砖引玉,就当前国内中药的创新探索情况进行浅析。
二、继承传统是提高中药新药临床效果的捷径
从2015年下半年国家药品监督管理局核查从严后,中药新药申请和审批的路异常艰难。2016年至今,CDE仅批准上市了5个中药新药和1个中药仿制药。
表1 2016—2019年获得新药批件的中药新药
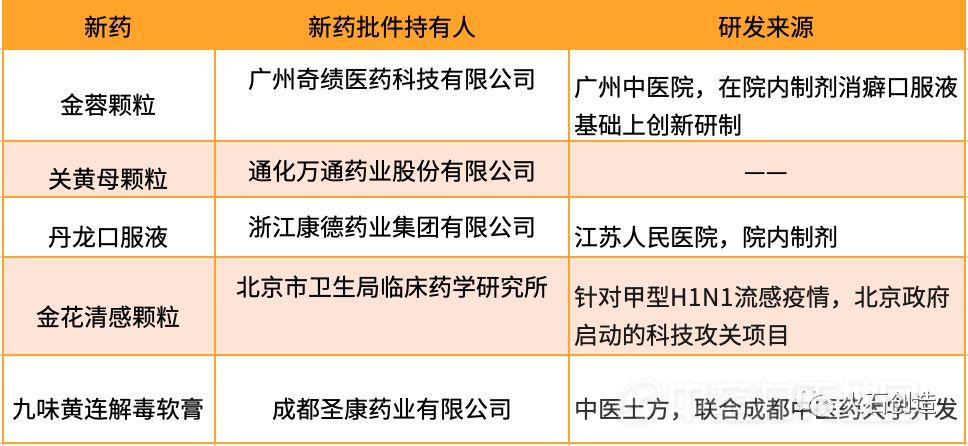
每个成功上市品种的背后都有值得学习的故事。金蓉颗粒和丹龙口服液来自院内制剂,九味黄连解毒软膏来自中医土方和高校科研技术开发,金花清感颗粒的成功得益于流感爆发形成的临床需求下政府主导的科技项目支持。从此可见,拥有确切、显著的临床疗效是开发中药新药的先决条件。而传承经典是寻找临床有效候选物的高效率渠道,例如开发院内制剂、民间土方或借鉴已上市的名方。
三、科研是将经验转化为上市药品的关键因素
在5个中药新药中,4个品种的背后有明显的科研推动力。这种现象反映了中药新药审批部门的规则和理念。实际上,改革中的CDE高度学习欧美审批管理植物药的原则,严格围绕 “安全、有效、质量可控”的方针管理中药。在这样的监管政策下,中药新药必须更加重视研发,并且对研发能力和规范提出了要求。
医药科研机构需要充分利用先进的技术手段,系统开展药物质量研究,将混合物的成分和化学结构尽可能清晰明确,以符合“质量可控”的基本要求。同时,中药临床研究需在现代医学理念指导下开展,收集证据来阐明药物的安全性和有效性,以符合“安全有效”的基本要求。
要想在这样的变革下生存,一支优秀的科研团队是必要的,科研机构在此方面有绝对优势,而中药企业以往普遍不重视研发(现在重视的也不多),没有积累足够的科研人才和经验,在这个方面捉襟见肘。
四、IND蓄水池规模缩减但质量有所提升
IND的审批同样因循以上原则,2015年后获得临床批件的中药品种,基本迈进了以上监管门槛。2015年后CDE受理临床试验的中药品种,由高校、科研机构和医院的主导或参与的占比为37%,相比于2013—2014年22%的科研医疗机构参与率,有了显著提升。因此,近年获批临床的品种数量虽然比以前大幅缩减,但质量明显提高,未来几年的新药上市成功率也有望得到改善。
目前2016—2019年获批临床的研究项目有159个处于临床二期(59%),30个品种处于三期(19%),35个品种处于一期(22%)。临床一期试验数量平均每年增长8-9项,表明中药新药创制速度缓慢,还处于摸索前进阶段。
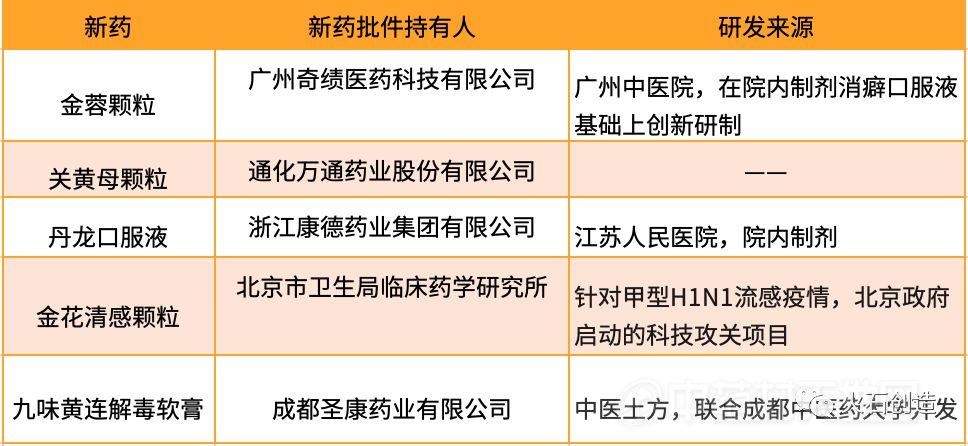
图1 2016—2019年中药临床试验数量
五、MAH提供的中药产学研途径
虽然中药创新在技术层面步履维艰,但在产业层面已开启新时代产学研合作的模式。MAH制度的福利已经惠及到多个中药新药品种,例如丹龙口服液获得新药生产批件的同时,浙江康德药业集团股份有限公司成为了药品上市许可持有人,可自行生产该品。这是我国第一个中药新药MAH文号。
康德药业总经理胡增仁认为,MAH制度与自主知识产权、中医理论突破和工艺稳定体系一起,构成了丹龙口服液能够顺利获批上市的四大主要因素。同样,成都圣康药业也为其中药新药九味黄连解毒软膏申请了MAH持有人文号,以解决该药业无力筹办药品生产设施的困局。研发机构也已经加入到中药MAH持有人队伍中,2018年获批的金蓉颗粒是第一个由研发机构作为持有人进行委托生产的中药品种。
MAH制度的初衷是鼓励创新、整合产能,在这个制度的推动下,科研机构将真正分享到其科研成果带来的利益,而不必沦落到卖新药批件的尴尬境地,从而为中药产学研结合的创新道路铺平了政策基石。
六、中药行业研发热点
除了常规的中药复方制剂研发,中药的主流研发创新方向还有天然药物、经典名方和优质品种二次开发。这些研发热点凭借其独特的技术优势,背负着中药创新发展的无数期待。
(一)古代经典名方凭借安全性缩短了研发流程
中成药是中医处方的物质体现,“古代经典名方”是指至今仍广泛应用、疗效确切、具有明显特色与优势的古代中医典籍所记载的方剂。因为安全性高,《中医药法》和《古代经典名方中药复方制剂简化注册审批管理规定》对古代经典名方开发出的中药复方制剂给予了特殊审批,明确来源于古代经典名方的中药复方制剂,在申请上市药品批准文号时,不需提供药效学研究及临床试验资料,仅需提供药学及非临床安全性研究资料。
这意味着其研发流程的极大缩短和成功率的大幅提升。2018年4月国家中医药管理局发布第一批古代经典名方目录,包含100个复方。全国中药企业迅速开展研究,目前暂时没有产品审批上市。
(二)品种二次开发是用新模式激活老品种
中药品种二次开发是围绕中药的五大瓶颈问题——临床定位宽泛,药效物质不清,作用机制不明,制药工艺粗放,质控水平低下——开展的研究,整合应用现代药理学、药代动力学、药物代谢学等技术,明确中药品种的物质成分及作用机理,实现基于活性成分的质量控制,并在此基础上,开展临床适应症的优化和扩展。
典型代表是张伯礼院士与刘昌孝院士牵头的中药大品种二次开发系列研究课题,对六味地黄丸、元胡止痛滴丸、疏风解毒胶囊等多个中药大品种进行了二次开发,为大品种培育的质量标准提升、临床推广应用提供了技术支撑,为企业带来了良好的经济效益,同时赢得了可观的社会效益。
(三)天然药物是中药现代化的体现
天然药物虽然属于中药分类,但是其研究思路与中医理论关系不大,而是更趋向于化学药物的开发模式:从物质基础开始,力求突破中药“不清晰”的限制,实现物质-靶点-药效学-临床研究的连贯模式。
因此,天然药物开发对于基础科研能力提出了更高要求。2015年之后,中药复方仍然是CDE受理和审评的主战场,天然药物暂时没有新药获批上市,但已有品种进入IND和NDA环节。重庆秋纹生物的JNSW10032片(中药1.1类)和五和博澳的桑枝总生物碱片(中药5类)的NDA申请已被纳入优先审评,在审评阶段的NDA品种还有侧金盏口腔溃疡贴片、黄蜀葵花总黄酮提取物和泽泻醇有效部位及其胶囊。
七、创新中药的适应症分析
自2016年开始,登记临床试验的134个中药品种中,治疗感冒和呼吸道疾病的品种有37个,治疗心脑血管疾病的品种有28个。感冒和呼吸道疾病、心脑血管疾病是中药的经典治疗领域,至今仍然占据中药临床研究的半壁江山。
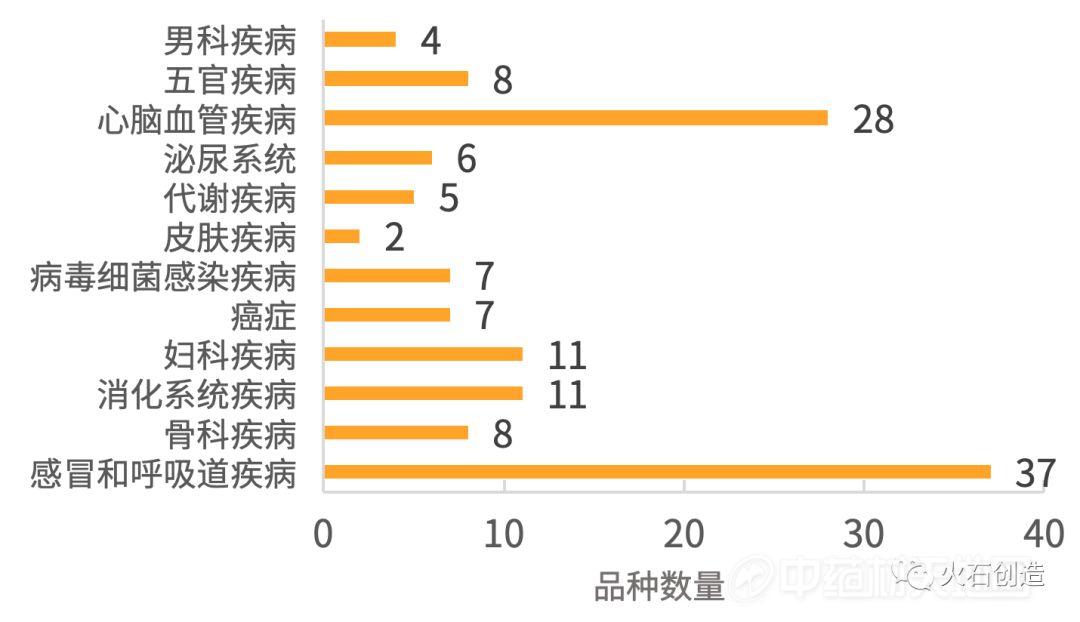 图2 2016—2019年临床试验的中药品种数量分布
图2 2016—2019年临床试验的中药品种数量分布
值得注意的是,有4个治疗感冒和呼吸道疾病的品种是面向儿童开发的小儿用药。实际上,儿童药是临床需求高度未满足的领域。近年在临床需求的引导下,将优质大品种二次开发成儿童药正在成为中药研发的趋势。国内很多中药企业已经布局了该类型的研发管线,甚至专门成立了儿药研究机构。
治疗癌症的临床中药品种有7个,其中5个针对肺癌,1个针对肝癌,1个针对白血病。相比于靶向药和生物药在肿瘤领域呈现品种爆发式的发展态势,中药在癌症治疗领域的潜力平平,这种现象恰好体现了药品审批的审慎态度。适应症宽泛、副反应不明的时代已一去不复返,“安全、有效、质量可控”是中药创新必须跨过的一道道长门。
八、小结
中药突围必须意识到中药新药研发的重要性,科研是将经验转化为上市药品的关键因素,而MAH提供了中药产学研途径,但中药企业往往研发投入、科研人才和经验方面存在局限。
余秋雨曾说,真正的自省,不是一种走向乖巧的心理调整,而是一种极其诚恳的自我剖析,无情地剥除自己身上每一点异己的成分,哪怕这些成分曾为它带来荣誉和利益。唯有如此,才能脱胎换骨,涅槃重生。
(本文转载自其他网站,不代表中药材天地网的观点和立场。如有著作权异议请及时联系我们)





 图2 2016—2019年临床试验的中药品种数量分布
图2 2016—2019年临床试验的中药品种数量分布