
为全面反映2018年我国药品不良反应监测情况,提高安全用药水平,更好地保障公众用药安全,国家药品不良反应监测中心组织编撰《国家药品不良反应监测年度报告(2018年)》。
一、药品不良反应监测工作情况
从1998年到2018年,国家药品不良反应监测工作已走过20年历程。在此期间,国家药品监督管理局着力构建药品不良反应监测体系、完善相关法律法规、扩大监测覆盖面、建立以风险防控为主的预警机制,不良反应监测工作得到快速发展。2018年,按照习近平总书记对食品药品安全提出的“四个最严”要求,秉承保障人民群众用药安全的主旨,药品不良反应监测工作取得新进展:
一是强化智慧监管,监测覆盖面进一步扩大。完善国家药品不良反应监测网络系统,开发建设持有人直接报告药品不良反应监测系统,监测覆盖面不断增大。2018年全国97.9%的区县报告了药品不良反应,每百万人口平均报告数为1119份,已实现十三五规划目标。继续拓展监测技术手段,与医疗机构合作建设了150余家监测哨点,为监测工作深入开展夯实基础。
二是深入开展安全性评价,及时处置风险预警信号。根据监测数据分析评价结果,2018年共发布药品说明书修订公告33期、停止吡硫醇注射剂、特酚伪麻片、磺胺索嘧啶片和特洛伪麻胶囊生产销售使用、发布《药物警戒快讯》12期。继续优化预警系统,对重点关注的150余个药品不良反应事件聚集性信号及时进行处置,做到早发现、早应对、早调查、早处置,保障公众用药安全。
三是夯实上市许可持有人药品安全主体责任。2018年9月,国家药品监督管理局发布《关于药品上市许可持有人直接报告不良反应事宜的公告》(2018年第66号)和《关于发布个例药品不良反应收集和报告指导原则的通告》(2018年第131号),进一步强化上市许可持有人药品安全主体责任,对上市许可持有人开展监测、报告、分析和评价提出具体要求。
二、药品不良反应/事件报告情况
(一)报告总体情况
1. 2018年度药品不良反应/事件报告情况
2018年全国药品不良反应监测网络收到《药品不良反应/事件报告表》149.9万份。1999年至2018年,全国药品不良反应监测网络累计收到《药品不良反应/事件报告表》1368万份(图1)。

图1 1999年-2018年全国药品不良反应/事件报告数量增长趋势
2.新的和严重药品不良反应/事件报告情况
2018年全国药品不良反应监测网络收到新的和严重药品不良反应/事件报告49.5万份;新的和严重药品不良反应/事件报告占同期报告总数的33.1%。新的和严重药品不良反应/事件报告比例持续增加,显示我国药品不良反应报告可利用性持续增加。
2018年全国药品不良反应监测网络收到严重药品不良反应/事件报告14.9万份,严重药品不良反应/事件报告占同期报告总数的10.0%(图2)。

图2 2004年-2018年新的和严重以及严重药品不良反应/事件报告比例
小贴士:
是不是药品不良反应报告数量增多,药品就越不安全?
药品不良反应监测工作是药品上市后安全监管的重要支撑,其目的是为了及时发现、及时控制药品安全风险。《药品不良反应报告和监测管理办法》中规定国家实行药品不良反应报告制度,药品生产企业、经营企业、医疗机构应当报告所发现的药品不良反应,国家鼓励公民、法人和其他组织报告药品不良反应,个人发现药品不良反应后,可以向主治医师报告,也可向药品生产、经营企业或者当地的药品不良反应监测机构报告,必要时提供相关的病例资料。
经过各方努力,药品生产企业、经营企业、医疗机构药品不良反应报告的积极性逐步提高,我国药品不良反应报告数量总体呈上升趋势。严重药品不良反应/事件报告比例是国际通用的衡量总体报告质量和可利用报告的重要指标之一,监测评价工作一直将收集和评价新的和严重药品不良反应作为重点工作内容,新的和严重药品不良反应报告,尤其是严重药品不良反应报告数量多了,并不能说明药品安全水平下降,而意味着监管部门掌握的信息越来越全面,对药品的风险更了解,风险更可控,对药品的评价更加有依据,监管决策更加准确。同样,在医疗实践中,能及时地了解药品不良反应发生的表现、程度,并最大限度地加以避免,也是保证医疗安全的重要措施。
3.每百万人口平均报告情况
每百万人口平均报告数量是衡量一个国家药品不良反应监测工作水平的重要指标之一。2018年我国每百万人口平均报告数为1119份。
4.药品不良反应/事件县级报告比例
药品不良反应/事件县级报告比例是衡量我国药品不良反应监测工作均衡发展及覆盖程度的重要指标之一。2018年全国药品不良反应/事件县级报告比例为97.9%。
5.药品不良反应/事件报告来源
药品生产企业、经营企业和医疗机构是药品不良反应报告的责任单位。按照报告来源统计,2018年来自医疗机构的报告占86.8%;来自药品经营企业的报告占8.0%;来自药品生产企业的报告占5.1%;来自个人及其他报告者的报告占0.1%(图3)。

图3 2018年药品不良反应/事件报告来源分布
6.报告人职业
按照报告人职业统计,医生占55.2%,药师占23.0%,护士占15.3%,其他职业占6.5%(图4)。
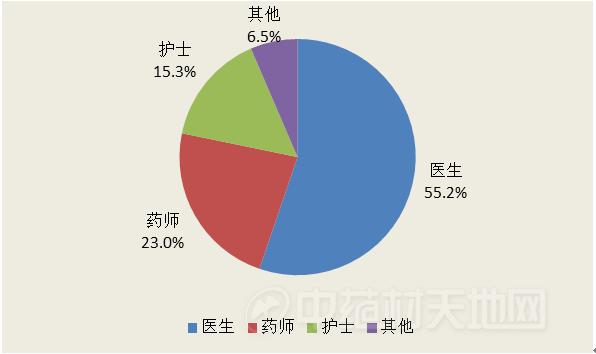
图4 报告人职业构成
7.药品不良反应/事件报告涉及患者情况
2018年药品不良反应/事件报告中,男女患者比为0.86:1,女性略多于男性。14岁以下儿童患者的报告占9.8%;65岁以上老年患者的报告占27.7%(图5)。

图5 药品不良反应/事件报告涉及患者年龄分布
8.药品不良反应/事件报告涉及药品情况
按照怀疑药品类别统计,化学药品占83.9%、中药占14.6%、生物制品占1.5%(图6)。

图6 药品不良反应/事件报告涉及药品类别
按照药品给药途径统计,2018年药品不良反应/事件报告中,静脉注射给药占60.0%、其他注射给药占4.2%、口服给药占32.2%、其他给药途径占3.6%(图7)。

图7 药品不良反应/事件报告给药途径
9.药品不良反应/事件累及器官系统情况
2018年报告的药品不良反应/事件中,累及器官系统排名前5位的分别为皮肤及其附件损害、胃肠损害、全身性损害、神经系统损害和心血管系统损害(图8)。

图8 药品不良反应/事件累及器官系统
(二)基本药物监测情况
1.国家基本药物监测总体情况
2018年全国药品不良反应监测网络共收到《国家基本药物目录》(2012版)收载品种的不良反应/事件报告62.7万份,其中严重报告6.5万份,占10.4%。报告涉及化学药品和生物制品占85.9%,中成药占14.1%。
2.国家基本药物化学药品和生物制品情况分析
《国家基本药物目录》(2012版)化学药品和生物制品部分涉及25个类别共317个(类)品种。2018年全国药品不良反应监测网络共收到药品不良反应/事件报告55.1万例次,其中严重报告6.6万例次,占11.9%。
2018年国家基本药物化学药品和生物制品不良反应/事件报告,按照药品类别统计,报告数量排名前5位的分别是抗微生物药、心血管系统用药、抗肿瘤药、调节水电解质及酸碱平衡药、维生素矿物质类药;累及器官系统排名前5位的是皮肤及其附件损害、胃肠损害、全身性损害、神经系统损害以及心血管系统损害。
3.国家基本药物中成药情况分析
《国家基本药物目录》(2012版)中成药部分涉及内科用药、外科用药、妇科用药、眼科用药、耳鼻喉科用药、骨伤科用药6大类共203个品种。2018年全国药品不良反应监测网络共收到药品不良反应/事件报告90607例次,其中严重报告7435例次,占8.2%。
2018年国家基本药物中成药部分6大类中,药品不良反应/事件报告总数由多到少依次为内科用药、骨伤科用药、妇科用药、外科用药、耳鼻喉科用药、眼科用药。2018年国家基本药物监测总体情况基本保持平稳。
(三)化学药品、生物制品监测情况
1.总体情况
2018年药品不良反应/事件报告中,涉及怀疑药品159.7万例次,其中化学药品占83.9%,生物制品占1.5%。2018年严重不良反应/事件报告涉及怀疑药品18.4万例次,其中化学药品占89.1%,生物制品占2.0%。
2.涉及患者情况
2018年化学药品、生物制品不良反应/事件报告中,男女患者比为0.86:1,女性略多于男性。14岁以下儿童患者的报告占9.8%;65岁以上老年患者的报告占27.9%,严重报告中该比例为32.2%。2018年化学药品、生物制品涉及患者情况与总体构成基本一致。
3.涉及药品情况
2018年药品不良反应/事件报告涉及的化学药品中,例次数排名前5位的类别为抗感染药,心血管系统用药,肿瘤用药,电解质、酸碱平衡及营养药,神经系统用药。2018年化学药品严重药品不良反应/事件报告中,报告数量最多的为抗感染药,占33.3%;其次是肿瘤用药,占26.1%。化学药品类别中,肿瘤用药的严重报告比例最高,为34.0%,其次为免疫系统用药,为23.4%。
2018年药品不良反应/事件报告涉及的生物制品中,抗毒素及免疫血清占33.2%,细胞因子占24.5%,血液制品占5.7%。
按剂型统计,2018年化学药品不良反应/事件报告中,注射剂占67.0%、口服制剂占30.0%、其他制剂占3.0%;生物制品中注射剂占96.5%、口服制剂占0.5%、其他制剂占3.0%。
4.总体情况分析
在化学药品不良反应/事件报告总体排名中,抗感染药的报告数量继续居首位,但占化学药总体报告数量的比例呈连年下降趋势,然而其严重报告构成比较去年略有升高,提示抗感染药的使用风险仍需关注。肿瘤用药的严重报告构成比居首位,提示应关注肿瘤用药的相关风险。在患者年龄分布中,老年患者报告比例继续升高,提示应持续关注老年人群用药安全。
(四)中药监测情况
1.总体情况
2018年药品不良反应/事件报告中,涉及怀疑药品159.7万例次,其中中药占14.6%;2018年严重不良反应/事件报告涉及怀疑药品18.4万例次,其中中药占8.7%。
2.涉及患者情况
2018年中药不良反应/事件报告中,14岁以下儿童患者占7.6%,65岁以上老年患者占27.1%。
3.涉及药品情况
2018年药品不良反应/事件报告涉及的中药药品中,例次数排名前5位的类别分别是理血剂中活血化瘀药(29.7%)、清热剂中清热解毒药(10.2%)、开窍剂中凉开药(7.3%)、补益剂中益气养阴药(7.2%)、解表剂中辛凉解表药(5.4%)。2018年中药严重药品不良反应/事件报告的例次数排名前5位的类别分别是理血剂中活血化瘀药(41.2%)、补益剂中益气养阴药(13.7%)、开窍剂中凉开药(12.0%)、清热剂中清热解毒药(7.0%)、解表剂中辛凉解表药(4.4%)。
2018年中药不良反应/事件报告按照给药途径分布,静脉注射给药占48.7%,其他注射给药占0.6%,口服给药占43.6%,其他给药途径占7.1%。
4.总体情况分析
2018年中药不良反应/事件报告数量略有下降。从药品类别看,主要涉及活血化瘀类、清热解毒类、凉开类、益气养阴类等。
小贴士:
合理用药提示
1.优先使用基本药物;
2.遵循能不用就不用、能少用就不多用,能口服不肌注、能肌注不输液的原则;
3.买药要到合法医疗机构和药店,注意区分处方药和非处方药,处方药必须凭执业医师处方购买;
4.阅读药品说明书,特别要注意药物的禁忌、慎用、注意事项、不良反应和药物间的相互作用等事项;
5.处方药要严格遵医嘱,切勿擅自使用。特别是抗菌药物和激素类药物,不能自行调整用量或停用;
6.任何药物都有不良反应,非处方药长期、大量使用也会导致不良后果;
7.孕期及哺乳期妇女用药要注意禁忌;儿童、老人和有肝脏、肾脏等方面疾病的患者,用药应谨慎,用药后要注意观察;从事驾驶、高空作业等特殊职业者要注意药物对工作的影响;
8.药品存放要科学、妥善;谨防儿童及精神异常者误服、误用。
三、相关风险控制措施
根据2018年药品不良反应监测数据和分析评价结果,国家药品监督管理局对发现存在安全隐患的药品及时采取相应风险控制措施,以保障公众用药安全。
(一)发布停止生产销售使用吡硫醇注射剂、特酚伪麻片、磺胺索嘧啶片和特洛伪麻胶囊的公告。
(二)发布含钆对比剂、甲巯咪唑片、双黄连注射剂等药品说明书的修订公告33期,增加或完善说明书中的警示语、不良反应、注意事项、禁忌等相关安全性信息。
(三)发布《药物警戒快讯》12期,提示国外药品安全信息59条。
四、各论
根据药品不良反应监测结果以及公众关注情况,国家药品不良反应监测中心对抗感染药、心血管系统用药、肿瘤用药、老年人用药监测情况进行了分析,并对安全风险提示如下:
(一)关注抗感染药用药风险
抗感染药是指具有杀灭或抑制各种病原微生物作用的药品,包括抗生素、合成抗菌药、抗真菌药、抗病毒药等,是临床应用最为广泛的药品类别之一,其不良反应/事件报告数量一直居于首位,是药品不良反应监测工作关注的重点。
2018年全国药品不良反应监测网络共收到抗感染药不良反应/事件报告52.2万份,其中严重报告4.9万份,占9.4%。抗感染药不良反应/事件报告占2018年总体报告的34.8%。
1.涉及药品情况
2018年抗感染药不良反应/事件报告数量排名前3位的药品类别是头孢菌素类、喹诺酮类、大环内酯类,严重不良反应/事件报告数量排名前3位的药品类别是头孢菌素类、喹诺酮类、抗结核病药。
2018年抗感染药不良反应/事件报告中,注射剂占80.3%,口服制剂占17.5%,其他剂型占2.2%,与药品总体报告相比,注射剂比例偏高。严重不良反应/事件报告中,注射剂占81.8%,口服制剂占17.3%,其他剂型占0.9%,与药品总体严重报告相比,注射剂比例偏高。
2.累及器官系统情况
2018年抗感染药不良反应/事件报告中,整体报告和严重报告的药品不良反应/事件累及器官系统情况详见图9。与抗感染药的整体报告相比,严重报告的全身性损害、免疫功能紊乱和感染、呼吸系统损害构成比明显升高。
抗感染药整体药品不良反应/事件报告中,口服制剂累及器官系统前5位是胃肠损害、皮肤及其附件损害、神经系统损害、肝胆损害和全身性损害;注射剂累及器官系统前5位是皮肤及其附件损害、胃肠损害、全身性损害、免疫功能紊乱和感染、神经系统损害。
抗感染药严重药品不良反应/事件报告中,口服制剂累及器官系统排名前5位的是肝胆损害、皮肤及其附件损害、胃肠损害、全身性损害、代谢和营养障碍;注射剂累及器官系统排名前5位的是皮肤及其附件损害、全身性损害、免疫功能紊乱和感染、呼吸系统损害、胃肠损害(图9)。

图9 抗感染药不良反应/事件累及器官系统情况
3. 监测情况分析及安全风险提示
近年来,抗感染药不良反应/事件报告占总体报告比例呈现持续下降趋势,提示临床加强抗感染药使用管理等措施取得一定实效,但其严重不良反应风险仍需继续关注。
小贴士:
含头孢哌酮药品导致凝血障碍及出血风险的影响因素有哪些?
含头孢哌酮药品存在致维生素K依赖性凝血障碍,其机制很可能与合成维生素的肠道菌群受到抑制有关,包括营养不良、吸收不良(如肺囊性纤维化患者)、酒精中毒患者和长期静脉输注高营养制剂在内的患者存在上述风险,此外合并血液系统疾病、肝肾疾病、并用抗凝药物、用药剂量大、用药时间长以及老年患者可能是含头孢哌酮药品产生凝血障碍和出血的风险因素。国家药品监督管理局已发布关于修订含头孢哌酮药品说明书的公告(2019年第13号),提示临床使用含头孢哌酮药品时应监测上述患者以及接受抗凝血药治疗患者的凝血酶原时间,必要时需额外补充维生素K。此外,建议临床使用含头孢哌酮药品时,仔细阅读药品说明书,充分权衡利弊。
(二)关注心血管系统用药风险
心血管系统用药是指用于心脏疾病治疗、血管保护、血压和血脂调节的药品,包括降血压药、抗心绞痛药、血管活性药、抗动脉粥样硬化药、抗心律失常药、强心药和其他心血管系统药。近年来,心血管系统用药不良反应/事件报告数量及严重报告占比均呈现上升趋势,提示应对该类药品风险给予更多的关注。
2018年全国药品不良反应监测网络共收到心血管系统用药的不良反应/事件报告12.9万例,占总体报告的8.6%;其中严重报告8266例,占6.4%。
1.涉及患者情况
按性别统计,2018年心血管系统用药不良反应/事件报告中,女性患者比男性患者高1.1个百分点;严重报告中,男性患者比女性患者高4.5个百分点。
按年龄统计,2018年心血管系统用药不良反应/事件报告中,45-64岁与65岁及以上年龄组分别占43.9%和43.6%,远高于其他年龄组比例;严重报告中,65岁及以上年龄组占49.9%(图10)。

图10 心血管系统用药不良反应/事件报告涉及患者年龄分布
2.涉及药品情况
2018年心血管系统用药不良反应/事件报告,数量排名前3位的药品类别是降血压药、抗心绞痛药、血管活性药,心血管系统用药严重报告,排名前3位的药品类别是抗动脉粥样硬化药、降血压药、抗心绞痛药。
2018年心血管系统用药不良反应/事件报告中,注射剂占42.8%,口服制剂占56.8%,其他剂型占0.4%;严重报告中,注射剂占52.9%,口服制剂占46.8%,其他剂型占0.3%。
3.累及器官系统情况
2018年心血管系统用药不良反应/事件报告中,口服制剂累及器官系统排名前5位的是神经系统损害、胃肠损害、全身性损害、呼吸系统损害和皮肤及其附件损害;注射剂累及器官系统前5位是神经系统损害、皮肤及其附件损害、全身性损害、胃肠损害、血管损害和出凝血障碍(图11)。

图11 心血管系统用药不良反应/事件累及器官系统分布情况
4.监测情况分析及安全风险提示
统计分析结果显示,65岁及以上年龄组心血管系统用药患者报告数量及严重不良反应/事件报告占比均明显高于总体报告中该年龄组患者水平,提示老年患者是心血管系统用药的主要群体,而且随着年龄的增长发生严重不良反应的比例显著升高。
2018年心血管系统用药不良反应/事件报告中,涉及口服制剂的报告比例较注射剂高出14.0个百分点,提示心血管系统用药不良反应/事件报告更多来自口服给药途径。在该类药品口服制剂中,他汀类产品严重不良反应/事件报告数量最多,这可能与他汀类药品使用较多有关,他汀类药品除用于血脂代谢紊乱及相关心血管疾病的治疗,还用于此类疾病的预防,不排除其中存在的不合理、不规范使用情况,提示医务人员和患者应关注此类药品的风险。
小贴士:
1.心血管疾病患者用药应注意什么?
心血管疾病近年来呈现高发趋势,其中老年人是高发人群,而且往往存在高血压、高血糖、高血脂等危险因素,联合用药情况较多,用药情况比较复杂,容易发生严重不良反应。因此,医务人员应结合患者的基础疾病和用药情况,给予患者适宜的药品。患者应仔细阅读说明书,按照正确方法用药,不能擅自改变剂量或停药。如果用药过程中出现严重不良反应,应及时就医。
2.他汀类药品严重不良反应表现有哪些?
他汀类药品常用于血脂代谢紊乱及相关心血管疾病的治疗和预防,目前国内上市的产品包括阿托伐他汀、瑞舒伐他汀、辛伐他汀、洛伐他汀等,此类药品严重不良反应主要表现为肝功能异常、肝酶异常、横纹肌溶解、肌痛、肌酸磷酸激酶升高等。患者在使用此类药品前应仔细阅读药品说明书不良反应、注意事项、警示、禁忌等安全性提示信息,服用药品期间如出现不适,建议就医。
(三)关注肿瘤用药不良反应/事件
临床使用的抗肿瘤药包括传统的烷化剂、抗代谢药、抗肿瘤抗生素等化学治疗药物,也包括新兴药物如分子靶向药物、免疫治疗药物等,我们密切关注这些抗肿瘤药的安全风险。2018年全国药品不良反应监测网络共收到肿瘤用药不良反应/事件报告8.0万例,占2018年总体药品不良反应/事件报告的5.3%。其中严重报告2.7万例,占肿瘤用药不良反应/事件报告的34.0%,占2018年总体严重不良反应/事件报告的18.2%。
1. 涉及患者情况
按性别统计,2018年肿瘤用药不良反应/事件报告中,女性患者多于男性,男女患者比为0.79:1,严重报告男女患者比为0.77:1。
按年龄统计,2018年肿瘤用药不良反应/事件报告中,45-64岁年龄组报告例数最多,占53.0%,其次为65岁及以上组,占30.0%,严重报告情况类似。
2. 涉及药品情况
按剂型统计,2018年肿瘤用药不良反应/事件报告中,注射剂占87.2%,口服制剂占12.4%,其他剂型占0.4%;严重报告中,注射剂占89.5%,口服制剂占10.1%,其他剂型占0.4%。与2018年总体药品不良反应/事件报告相比,注射剂占比偏高。
3. 累及器官系统情况
2018年肿瘤用药不良反应/事件总体报告累及器官系统的前5位为血液系统损害、胃肠损害、全身性损害、皮肤及其附件损害、血管损害和出凝血障碍,严重报告累及器官系统的前5位为血液系统损害、胃肠损害、全身性损害、血管损害和出凝血障碍、皮肤及其附件损害。总体而言,骨髓抑制、白细胞减少、粒细胞减少、血小板减少等血液系统损害,恶心、呕吐、腹泻等胃肠损害,以及发热、乏力等全身性损害是肿瘤用药最常见的不良反应/事件,严重报告中血液系统损害所占比例尤高(图12)。
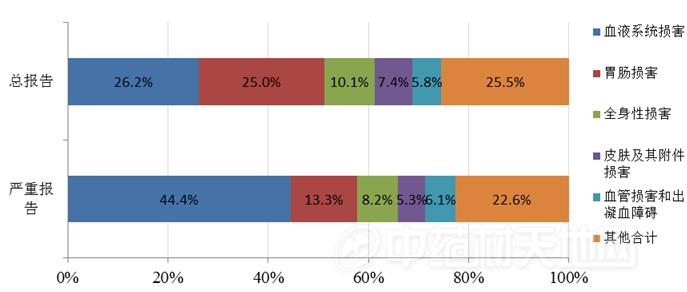
图12 肿瘤用药不良反应/事件累及器官系统情况
4. 监测情况分析及安全风险提示
随着疾病谱的改变,肿瘤发生增多以及患者带癌生存时间延长,肿瘤用药使用增多,不良反应/事件的发生和报告相应增加。近年来,肿瘤用药的不良反应/事件报告数量以15%左右的年均增长速度逐年上升,严重报告的年均增长速度更高,肿瘤用药严重报告占总体严重报告的比例逐年递增。此外,肿瘤患者通常基础条件较差,发生严重不良反应/事件的风险较高,医生和患者均应重视可能的不良反应/事件,合理用药、适当预防、及时干预,尽量避免因严重不良反应/事件影响治疗。
小贴士:
1. 化疗药有哪些不良反应?
化疗药在杀伤肿瘤细胞的同时,也损伤处于增殖活跃期的正常组织细胞(如骨髓、胃肠上皮、毛囊等),是其发生不良反应的主要原因。化疗药常见的不良反应包括骨髓抑制、恶心、呕吐、脱发、肝肾毒性等,还有一些发生频率不高、但可引起严重后果的不良反应,例如:伊立替康引起的迟发性腹泻,严重时可致命;长春碱类导致的便秘,严重时可发生麻痹型肠梗阻;多柔比星的蓄积性心脏毒性,可导致心力衰竭;门冬酰胺酶、紫杉醇类药可引起严重过敏反应,甚至过敏性休克。
2. 分子靶向抗肿瘤药有哪些不良反应?
分子靶向抗肿瘤药是在细胞分子水平上,针对肿瘤发生、发展及转移过程中起关键作用的特定分子和相关信号通路设计的药物。这类药物主要针对病变细胞,与化疗药相比,分子靶向抗肿瘤药引起的骨髓抑制、脱发发生较少,恶心、呕吐程度较轻。据国内外现有资料,目前临床使用的分子靶向抗肿瘤药最常见的不良反应是皮肤及其附件损害,如皮疹、脂溢性皮炎、黏膜反应等;也有报告较少、但可引起严重后果的不良反应/事件,如《药物警戒快讯》提示过的伊马替尼的充血性心力衰竭风险,利妥昔单抗的中毒性表皮坏死松懈症、Stevens-Johnson综合征以及乙型肝炎病毒再激活风险,贝伐珠单抗的血栓性微血管病、坏死性筋膜炎风险,伊布替尼的室性心动过速风险,血管内皮生长因子受体酪氨酸酶抑制剂的动脉血管壁异常结构改变风险。
(四)关注老年人用药安全
2018年全国药品不良反应监测网络中65岁以上老年患者相关的报告占27.7%。2018年共收到老年患者严重报告占老年患者报告总数的11.5%,略高于2018年总体报告中严重报告比例。
1.涉及老年患者情况
2018年老年患者药品不良反应/事件报告中,男女患者比为0.96:1。老年患者年龄分布情况, 65-69岁老年患者报告占33.6%,70-74岁老年患者报告占25.1%(图13)。
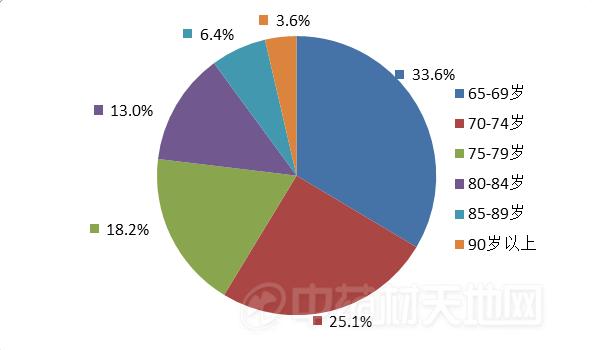
图13 老年患者药品不良反应/事件报告年龄分布
2.涉及药品情况
按照药品类别统计,化学药品占86.9%,中药占12.4%,生物制品占0.7%。化学药品排名靠前的是抗感染药、电解质、酸碱平衡及营养药、心血管系统用药、神经系统用药、肿瘤用药。中药排名靠前的是理血剂、补益剂、开窍剂、祛湿剂、清热剂。
按照药品剂型统计,注射剂占68.3%,口服制剂占27.5%,其他制剂占4.2%(图14)。

图14 老年患者药品不良反应/事件报告剂型分布
3.累及器官系统情况
2018年老年患者药品不良反应/事件报告中,累及器官系统排名前5位的是胃肠损害、皮肤及其附件损害、全身性损害、神经系统损害、心血管系统损害。化学药品、中药累及器官系统排名前5位的与总体基本一致(图15)。

图15 老年患者药品不良反应/事件累及器官系统情况
4.监测情况分析及安全风险提示
2018年老年患者药品不良反应/事件报告占报告总数的27.7%;老年患者严重报告所占比例高于整体报告中严重报告的构成比,提示老年患者受基础疾病较多、机体代谢水平较差以及用药情况复杂等因素影响,发生药品不良反应的风险更大,因此应持续关注老年人群用药安全。
从2018年的统计数据看,在药品分布上,老年患者用药的化学药品中,电解质、酸碱平衡及营养药、心血管系统用药、神经系统用药的构成比高于化学药总体报告中该分类的构成比,提示老年患者使用以上药品较多,不良反应发生情况较多。
五、有关说明
(一)本年度报告中的数据来源于国家药品不良反应监测数据库中2018年1月1日至2018年12月31日各地区上报的数据。
(二)与大多数国家一样,我国药品不良反应报告是通过自发报告系统收集并录入到数据库中的,存在自发报告系统的局限性,如漏报、填写不规范、信息不完善、无法计算不良反应发生率等。
(三)每种药品不良反应/事件报告的数量受到该药品的使用量和不良反应发生率等诸多因素的影响,故药品不良反应/事件报告数量的多少不直接代表药品不良反应发生率的高低或者严重程度。
(四)本年度报告完成时,其中一些严重报告、死亡报告尚在调查和评价的过程中,所有统计结果均为现阶段数据收集情况的真实反映,有些问题并不代表最终的评价结果。
(五)专业人士会分析药品与不良反应/事件的关联性,提取药品安全性风险信息,根据风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入安全性信息,更新药品如何安全使用的信息等。在极少数情况下,当认为药品的获益不再大于风险时,药品也会撤市。
(六)本年度报告数据均来源于全国药品不良反应监测网络,不包含疫苗不良反应/事件的监测数据。
原标题:2018年国家药品不良反应监测年度报告(医药人必备)
(本文转载自其他网站,不代表中药材天地网的观点和立场。如有著作权异议请及时联系我们)

















