下拉刷新
加载中...
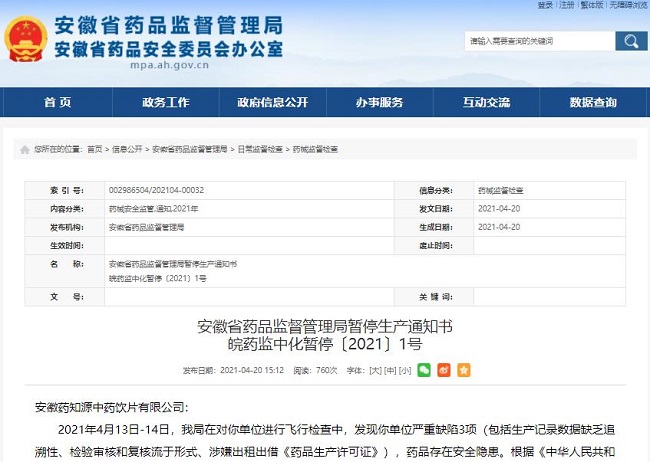
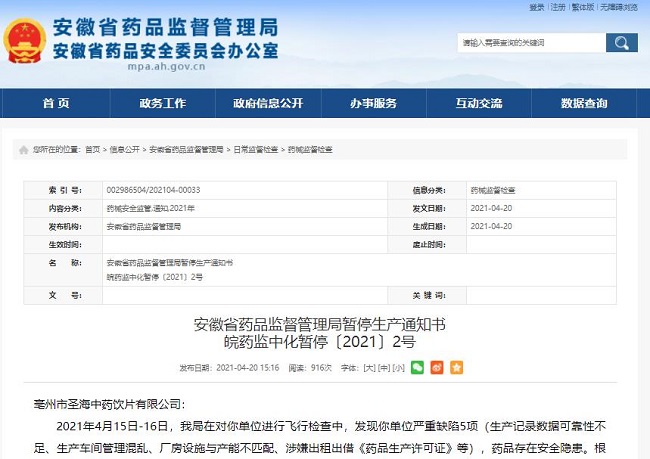
飞检:存在8项严重缺陷,2药企被停产
2021-04-23 10:58:24
推荐资讯
-
舆情监测
2020年国家药品抽检总不合格率为0.57% 中药饮片不合格率居首
2021-04-21 11:26
-
舆情监测
13批中药饮片不合格!
2021-04-19 15:56
-
舆情监测
福建省药监局发布通告!多批医药用品抽检不合格,有你在用的吗?
2021-04-19 15:02
-
舆情监测 法无禁止皆可为!亳州生产丹参粉执行四川炮规销售广东,胜诉!2021-04-13 09:59

-
舆情监测 55批药品(46批饮片)不合格,一家药企9次小通草;6批稻芽、7批车前草!原因?2021-04-13 09:52

热门资讯
-
舆情监测
北京同仁堂:全面接管“南极磷虾油”涉事企业
2026-01-05 11:19
-
舆情监测
17批饮片抽检不合格,柴胡等8批因性状
2026-01-04 09:28
-
舆情监测
重庆市药品监督管理局关于5批次药品不符合规定的通告
2026-01-12 13:20
-
舆情监测
太极集团拟增资4670万元强化中药材布局 披露2026年预计关联交易额度
2026-01-23 11:00
-
舆情监测
振东制药:预计2025年亏损2.2亿元至2.8亿元,整体市场供需关系影响部分中药材品种价格
2026-01-26 14:04
上拉刷新
加载中...
正在加载